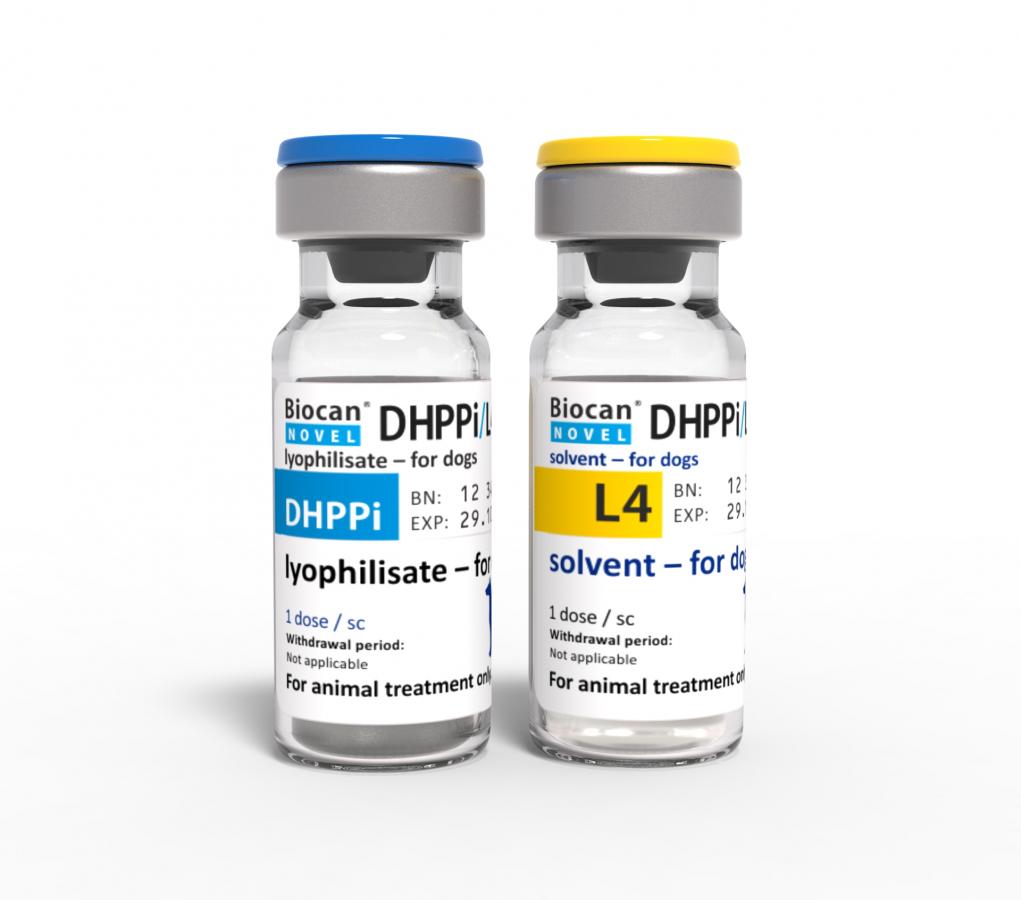
Biocan Novel DHPPi/L4 liofilizat i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań dla psów
Strona główna PRODUKTY PRODUKTY WETERYNARYJNE Biocan Novel DHPPi/L4 liofilizat i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań dla psów
Złożona szczepionka do aktywnej immunizacji psów od 6 tygodnia życia. Szczepionka jest przeznaczona do aktywnej immunizacji zdrowych szczeniąt i psów przeciwko chorobom wywołanym przez wirus nosówki parwowirus psów, adenowirus psów typu 1 i 2, wirus parainfluenzy psów oraz cztery typy bakterii Leptospira (Leptospira interrogans serogrupa Icterohaemorrhagiae serowar Icterohaemorrhagiae; Leptospira interrogans serogrupa Canicola serowar Canicola; Leptospira interrogans serogrupa Australis serowar Bratislava oraz Leptospira kirschneri serogrupa Grippotyphosa serowar Grippotyphosa).
| RODZAJ PRODUKTU: | szczepionka |
|---|---|
| gatunek zwierząt: | Pies |
| Zarejestrowany w Polsce | |
SKŁAD
Liofilizat (żywe atenuowane wirusy):
Wirus nosówki psów, szczep CDV Bio 11/A
min. 103,1 TCID50*, maks.105,1 TCID50*
Adenowirus psów typu 2, szczep CAV‐2‐Bio 13
min. 103,6 TCID50*, maks.105,3 TCID50*
Parwowirus psów typu 2b, szczep CPV‐2b‐Bio 12/B
min. 104,3 TCID50*, maks.106,6 TCID50*
Wirus parainfluenzy psów typu 2, szczep CPiV‐Bio 15
min. 103,1 TCID50*, maks.105,1 TCID50*
Rozpuszczalnik (inaktywowany):
Leptospira interrogans, serogrupa Icterohaemorrhagiae, serowar Icterohaemorrhagiae, szczep MSLB 1089 GMT** ≥ 1:51 ALR***
Leptospira interrogans, serogrupa Canicola, serowar Canicola, szczep MSLB 1090 GMT** ≥ 1:51 ALR***
Leptospira kirschneri, serogrupa Grippotyphosa, serowar Grippotyphosa, szczep MSLB 1091 GMT** ≥ 1:40 ALR***
Leptospira interrogans, serogrupa Australis, serowar Bratislava, szczep MSLB 1088 GMT** ≥ 1:51
* dawka zakaźna hodowli tkankowej 50%
**średnia geometryczna miana
***reakcja mikro-aglutynacyjna i mikro-lityczna przeciwciał (badanie serologiczne na królikach)
Adiuwant:
Wodorotlenek glinu (odpowiada Al2O3) 1,8-2,2 mg
WSKAZANIE
Czynne uodparnianie psów od 6 tygodnia życia.
- zapobieganie śmiertelności i objawom klinicznym, spowodowanym przez wirus nosówki
- zapobieganie śmiertelności i objawom klinicznym, spowodowanym przez adenowirus psów typu 1
- zapobieganie objawom klinicznym i zmniejszenie wydalania wirusa, spowodowanego przez adenowirus psów typu 2
- zapobieganie objawom klinicznym, leukopenii, wydalania wirusa, spowodowanym przez parwowirus psów
- zapobieganie objawom klinicznym (wyciek z nosa i oczu), zmniejszenie wydalania wirusa, spowodowanym przez wirus parainfluenzy psów
- zapobieganie objawom klinicznym, infekcji i wydalaniu z moczem, spowodowanym przez L.interrogans, serogrupa Australis, serowar Bratislava
- zapobieganie objawom klinicznym, wydalaniu z moczem, zmniejszenie infekcji, spowodowanym przez L. interrogans, serogrupa Canicola, serowar Canicola i L. interrogans, serogrupa Icterohaemorrhagiae, serowar Icterohaemorrhagiae
- zapobieganie objawom klinicznym, zmniejszenie infekcji, wydalania z moczem, spowodowanym przez L. kirschneri, serogrupa Grippotyphosa, serowar Grippotyphosa
Początek odporności:
- 3 tygodnie po pierwszym szczepieniu dla CDV, CAV, CPV,
- 3 tygodnie po ukończeniu podstawowego schematu szczepienia dla CPiV oraz
- 4 tygodnie po ukończeniu podstawowego schematu szczepienia dla składników Leptospira.
Okres trwania odporności:
Co najmniej trzy lata po ukończeniu podstawowego schematu szczepienia dla wirusa nosówki, adenowirusa psów typu 1, adenowirusa psów typu 2 oraz parwowirusa psów. Co najmniej jeden rok po ukończeniu podstawowego schematu szczepienia dla wirusa paragrypy psów oraz składnika szczepionki przeciwko leptospirozie.
Okres trwania odporności przeciwko adenowirusowi psów typu 2 (CAV-2) nie został określony metodą zakażania kontrolnego. Obecność przeciwciał przeciwko CAV-2 została wykazana nawet 3 lata po szczepieniu. Uważa się, że ochronna odpowiedź immunologiczna przeciw chorobom układu oddechowego spowodowanym przez CAV-2 trwa co najmniej 3 lata.
DAWKOWANIE
Podanie podskórne.
Dawkowanie i sposób podawania:
Liofilizat rozpuścić aseptycznie w rozpuszczalniku. Dobrze wstrząsnąć i od razu podać całą zawartość roztworu (1ml).
Szczepionka po rekonstytucji: lekko opalizujący, różowawy albo żółtawy roztwór
Podstawowy schemat szczepienia:
Dwie dawki preparatu Biocan Novel DHPPi/L4 podać w odstępie 3–4 tygodni, od 6 tygodnia życia.
Wścieklizna
Jeśli ochrona przeciw wściekliźnie jest wymagana:
Pierwsza dawka: Biocan Novel DHPPi/L4 od 8-9 tygodnia życia.
Druga dawka: Biocan Novel DHPPi/L4R 3-4 tygodnie później, ale nie wcześniej niż w wieku 12 tygodni.
Skuteczność frakcji przeciw wściekliźnie została udowodniona w badaniach laboratoryjnych po jednej dawce szczepionki, od 12 tygodnia życia.
Jednak w badaniach terenowych u 10 % seronegatywnych psów nie potwierdzono serokonwersji (> 0,1 IU/ml) od 3 do 4 tygodni po jednokrotnym, podstawowym szczepieniu przeciw wściekliźnie. U następnych 17 % nie potwierdzono miana przeciwciał przeciw wściekliźnie wynoszącego 0,5 IU/ml, wymaganego w przypadku podróży przez niektóre kraje poza obszarem UE. W przypadku podróży do obszarów o zwiększonym ryzyku albo podróży poza obszar UE lekarze weterynarii mogą zastosować dwie dawki podstawowego szczepienia, zawierające składnik przeciw wściekliźnie, albo zaaplikować dodatkową szczepionkę przeciw wściekliźnie po 12 tygodniu życia.
W razie potrzeby można zaszczepić psy młodsze niż 8 tygodni, ponieważ wykazano bezpieczeństwo preparatu Biocan Novel DHPPi/L4R u psów w wieku 6 tygodni.
Schemat szczepienia przypominającego:
Pojedyncza dawka preparatu Biocan Novel DHPPi/L4 powinna być podawana co 3 lata. Coroczne doszczepianie jest wymagane dla wirusa parainfluenzy i dla leptospir będących składnikiem szczepionki, dlatego jeśli jest to konieczne, pojedynczą dawkę kompatybilnej szczepionki Biocan Novel Pi/L4 można stosować corocznie.
OKRES PRZYDATNOŚCI DO UŻYCIA
24 miesiące. Po rozcieńczeniu wg wskazówek, szczepionkę należy podać bezzwłocznie.
PRZECHOWYWANIE
Przechowywać i transportować schłodzone 2 ° C - 8 ° C. Nie dopuszczać do zamarznięcia
OPAKOWANIE
10 × 1 dawka, 25 × 1 dawka.
Niektóre wielkości opakowań mogą nie być dostępne w obrocie